보고서 작성 시 도움이 되는 정보입니다. 실험 목적
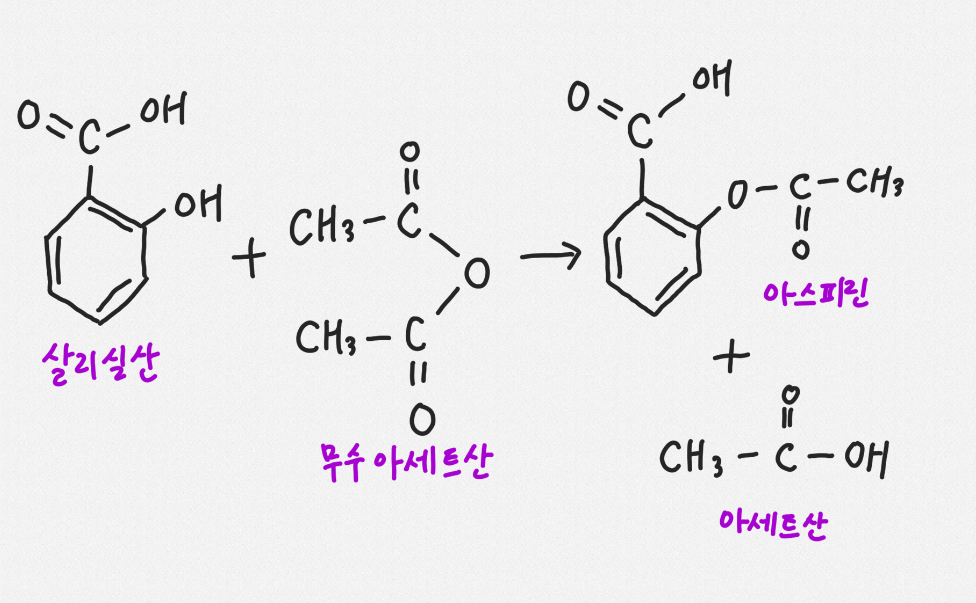
근대에서 가장 성공한 의약품 중 하나인 아스피린을 합성해 유기합성의 의미를 배운다. 실험 원리 및 관련 개념
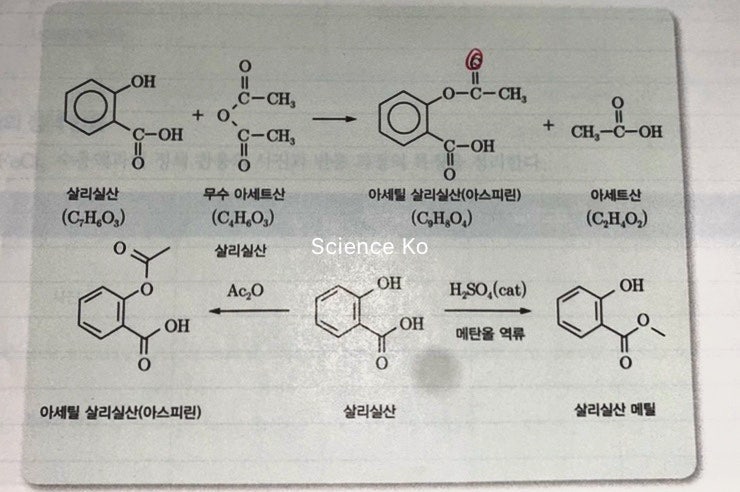
1) 아스피린 합성의약품 중 가장 성공한 것으로 알려진 아스피린은 상기와 같은 구조를 갖는 아세틸살리실산이라는 화합물로 방향족 벤젠 분자에 카르복실기와 에스터기가 결합된 비교적 간단한 구조로 되어 있다.
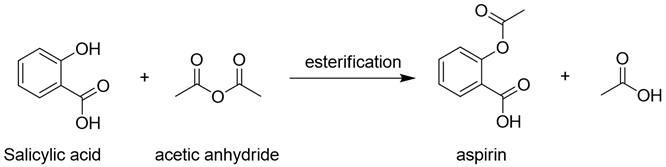
아스피린은 유기산의 일종으로 싼 화합물인 살리실산에 결합되어 있다 작용기-OH를 에스타화 반응에 변환해서 합성할 수 있다.에스더화 반응은 카르복시산과 알코올이 반응하고 에스더가 생성되는 반응에서 산성 용액으로 매우 빨리 일어난다.모기 본 산 대신 카봉실 무수 물을 이용하기도 한다.아스피린의 합성에서는 카르복시 무수 물로 아세트 산 무수 물을 이용하고 촉매로서 소량의 인산을 사용한다.이 실험에서 합성한 아스피린은 불순물을 함유하고 있어 그대로 의약품으로 사용할 수 없어 재결정의 방법으로 정제해야 한다.2)유기 합성 유기 화합물을 화학적으로 합성해서 탄소를 비롯한 원소를 희망하는 위치에 결합시키는 것이다.원자의 상대적인 결합만 아니라 3차원적인 구조까지 조절해야 하는 복잡한 과정이다.유기 합성으로 만들어지는 불순물은 유기 합성의 효율을 떨어뜨리고 합성한 물질을 실용적으로 이용할 수 없도록 하기도 한다.그러므로 반응의 효율을 높이고 불순물을 제거하는 것이 중요하다.유기 합성은 쉽게 구할 수 있는 시작 물질에서 한 단계나 다양한 단계에서 유기 화합물을 만드는 체계적인 제법이다.자연계에서 분리된 천연물이 유용한 의약적 특성을 지녔지만, 생체에서 매우 적은 양만 생산되는 것으로, 합성 화학자가 쉽게 시작 물질에서 이 화합물을 합성하고 많은 사람이 사용할 수 있도록 한다.때는 저절로 떨어지는 화합물을 만들어 자연에서 발견되는 관련 화합물보다 훨씬 좋은 성질을 갖기도 한다, 아스피린은 아주 잘 알려진 예이다.3)광학 이성질체 광학 이성질체 현상을 나타내는 2개의 분자는 분자를 구성하는 원자의 개수, 배열 위치도 모두 똑같다.그러나 두가지 물질을 각각 녹인 용액에 평면 편광을 통과시키면 편광이 서로 다른 방향으로 같은 각도만 회전하는 물질을 광학 이성질체라고 한다.또 광학 활성을 두 분자가 거울 대칭 관계를 이루는 경우를 가리키는 말이다.일반적으로 거울상 이성질체와 동의어로 사용한다.4)비대칭 중심 정사면체 구조를 취하며 분자에서 중심 원자에 결합하는 4개의 원자 또는 원자단이 모두 다른 때, 분자는 비대칭성이다.이런 분자에서 정사면체의 중심에 있는 분자를 비대칭 중심으로 한다.의약품 합성의 경우 서로 거울상에 해당하는 광학 이성질체가 서로 전혀 다른 생물 화학적 특성을 나타냈기 때문에 탄소를 중심으로 하는 비대칭 중심도 정확히 조절하며 원하는 이성질체만을 선택적으로 합성해야 하는 어려움도 극복하고 있다.5)비대칭 탄소 원자 비대칭 중심이 탄소 원자의 경우.비대칭 탄소 원자를 가지는 분자는 거울상 이성질체, 즉 광학 이성질체를 갖는다.한 분자의 비대칭 탄소 원자의 수:n개 → 광학 이성질체:2n개

6)에스타화 반응 에스테르(에스타)는 카르복시산-OH기를-OR에 치환한 화합물이다.산과 알코올에서 물이 빠지고 생성하는 화합물이다.카복실산과 알코올의 혼합물을 산(HCl, H2SO4)촉매 조건을 가열하면 이 혼합물은 생성물(에스테르와 물)과 평형 상태를 유지한다.이 반응을 에스더화 반응이라는.에스더화 반응의 메커니즘에서 물 분자는 카복실산의 하이드록 시기와 알코올 수소 원자에서 생성된다.다시 말하면 에스타화 반응은 알코올-OR기반으로 카르복시산-OH기가 서로 치환되는 반응이다.살리실산 에스타화 반응:C7H6O3+C4H6O3→ C9H8O4+C2H4O27)무수 물 화합물에서 물 분자가 유출된 형태의 화합물이다.아스피린 합성 반응에서는 카르복실산의 대신 카복실산 무수 물을 이용하기도 한다.카르복시 무수 물로 아세트 산 무수 물을 이용하고 촉매로서 소량의 인산을 사용한다.아세트 산 무수 물 분해:(CH3CO)2O+H2O→ CH3COOH+CH3CO++OH-8)정제 있는 물질을 합성할 때에 혼재하는 불순물을 제거하고 순도를 높이고 조작이다.그 방법으로 용해도 차이를 이용한 재결정이나 분별 결정, 증기 압력에 근거한 증류와 분별 증류 및 분배 흡착 이온 교환 크로마토 그래피 법, 전기 영동 법, 겔 여과 법 등 여러가지 방법이 사용된다.
9) 재결정 온도에 따른 용해도의 차이를 이용하여 원하는 용질을 다시 결정화시키는 방법이다. 혼합물을 뜨거운 용매에 녹인 후 다시 식히면 대부분 용해도가 줄어들고 용해도 이상으로 녹았던 용질은 침전물에 떨어진다. 만약 불순물의 양이 적고 우리가 관심을 갖고 있는 물질이 충분히 포함되어 있다면 용해도에 의한 침전물은 불순물이 포함되어 있지 않은 순수한 물질이 된다. 따라서 재결정 방법을 이용하여 불순물을 제거할 경우 불순물의 용해도는 크고 원하는 물질의 용해도는 비교적 작게 하는 용매를 선택하는 것이 바람직하다.



![[D Open tea timeout]Kim Mingyu, I'm going to 19 minutes tomorrow afternoon,Kim Hyunju3:41 p.m.m.m.m4.25 p.m.m.m.m8: 20 p.m.m.m Sungjae9:04.m.m, Cho Mingyu 12:05 [D Open tea timeout]Kim Mingyu, I'm going to 19 minutes tomorrow afternoon,Kim Hyunju3:41 p.m.m.m.m4.25 p.m.m.m.m8: 20 p.m.m.m Sungjae9:04.m.m, Cho Mingyu 12:05](https://toy.htit.kr/wp-content/plugins/contextual-related-posts/default.png)

